組織透明化試薬
学術コンテンツ
1.透明化の原理
組織透明化における重要なポイントは「光散乱の低減」です。通常、生体組織と溶媒 (生体組織が浸されている液体) の屈折率は異なりますが、この屈折率の差が光散乱の原因となります。従って、生体組織からの高屈折率成分除去や溶媒の高屈折率液体への置き換えで屈折率を均一にすることにより、組織を透明化することが可能になります。
これまでにもこの原理に基づく透明化技術が開発されていますが、これらには蛍光タンパク質を変性させるといった問題点がありました。そのため、これらの透明化技術を用いた解析においては種々の染色法を組み合わせる必要がありました。一方、顕微鏡や蛍光タンパク質といったイメージングに関連した技術は目覚ましい発展を見せており、組織の3次元解析に必要な技術基盤が整いつつあります。このような状況の中、近年では最新の蛍光顕微鏡技術や蛍光タンパク質との組み合わせに最適化した透明化技術の開発が盛んに進められ、組織の深部の3次元解析が可能になってきました。
2.透明化技術
2-1. Scale法 (ScaleA2法、ScaleS法)
従来の透明化技術においては有機溶媒が広く用いられていましたが、発光の過程で水分子を必要とする蛍光タンパク質はこの条件下で著しく褪色します。この問題に対して水溶液ベースの溶液を使用した透明化技術であるScale法 (ScaleA2法とScaleS法の総称) が開発されました1) 2)。Scale法では尿素と界面活性剤、グリセリン (ScaleA2法) もしくはソルビトール (ScaleS法) を組み合わせた溶液を光散乱の抑制に使用することで 、蛍光タンパク質を褪色させずに組織を透明化することが可能です。さらに、脱脂に必要な界面活性剤の含有量が少ないため、透明化後も超微細構造を良好に保持することが可能です。このように透明度と構造保持のバランスに優れたScale法は、初めて組織透明化にトライする方におすすめです。
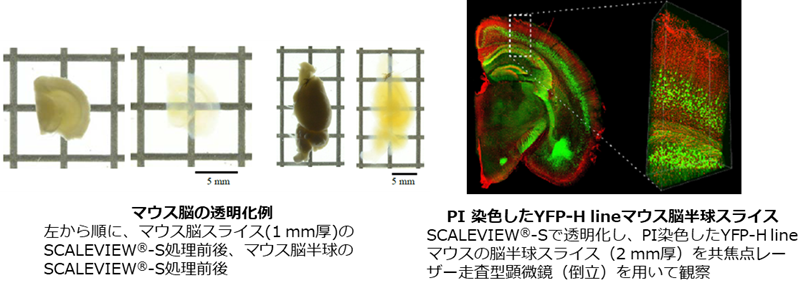
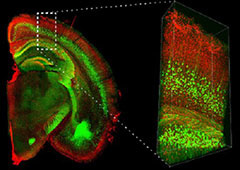
データご提供:国立研究開発法人理化学研究所 脳神経科学研究センター 細胞機能探索技術研究チーム /
光量子工学研究センター生命光学技術研究チーム 濱裕先生、星田哲志先生、宮脇敦史先生
協力:オリンパス株式会社
2-2. CUBIC法
Scale法よりもさらに深部を高精細に観察するためには、より透明度を向上させることが必要です。CUBICはScaleA2法で用いている3種類の試薬 (尿素、グリセリン、界面活性剤) を再検討することで開発された透明化技術です3)。グリセリンをアミノアルコールに代えることで、Scale法よりもさらに高い透明度を実現しています。これに加え、溶液に含まれるアミノアルコールが組織中の主要な吸光物質であるヘムを除去できることから、CUBIC法は血液を含む臓器の透明化にも有効な手段となっています4)。CUBIC法には第1世代と第2世代があり、第1世代CUBICには第2世代CUBICと比べ、①透明化の過程が目に見える ②サンプルの扱いが簡単 という特長があります。そのため、透明化初心者の方がトライする技術としておすすめです。一方、第2世代CUBIC は第1世代CUBICと比べて透明度が向上しており、透明化に要する時間も短くなっています。
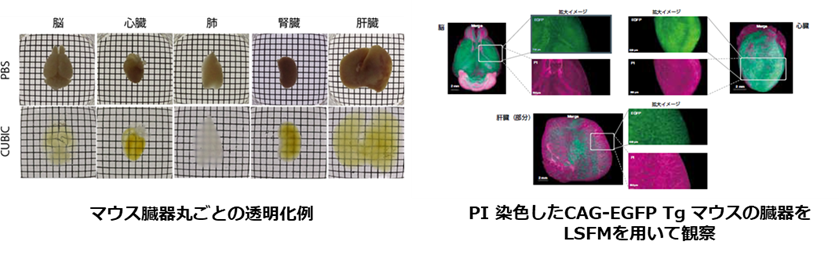
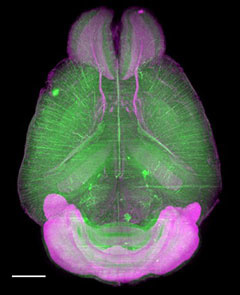
データご提供:国立研究開発法人理化学研究所 洲﨑悦生先生、上田泰己先生
2-3. SeeDB2法
CUBIC法やCLARITY法 (後述) を用いて透明化を行った場合、一時的に生体組織の大きさが変化し、微細な組織形態が損なわれることが問題となっていました。SeeDB2法はサポニンを含むイオヘキソールベースの溶液に生体組織を浸漬することで、超微細構造を保持したままの組織透明化を実現し、この問題を解決しました5)。使用する溶液は高屈折率であるため、屈折率の差により生じる影響を最小限に抑えられます。そのため、より深部のイメージングが可能です。溶液中に界面活性剤を用いていないため、他の手法と比較すると透明度は劣りますが、共焦点顕微鏡や超解像度顕微鏡により樹状突起スパインの形態を観察できるように、極めて優れた組織構造保持能力を有しています。さらに、SeeDB2法で使用する溶液は、蛍光タンパク質の安定性が高く、褪色の抑制にも適しています。一方で、DAPIやAlexa等の色素については光褪色が生じやすいので注意が必要です。
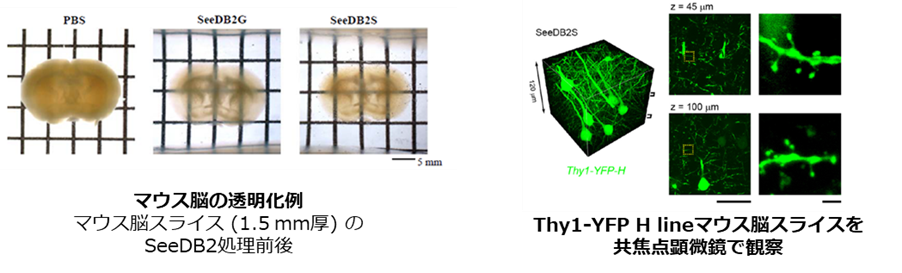
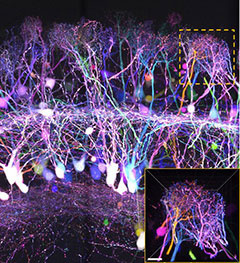
データご提供:国立大学法人 九州大学医学研究院 坂口理智先生、今井猛先生
国立研究開発法人理化学研究所 柯孟岑先生
2-4. CLARITY法
脳組織の透明化において最も難しいのは、髄鞘などに多く含まれる脂質の除去です。CLARITY法では、脳のタンパク質をポリアクリルアミドと重合させて架橋したうえで、SDSを含むバッファー中で電気泳動を行うことで脂質を除去します6)。他と比べて操作が煩雑であり、透明化に約1週間要しますが、細胞膜成分を積極的に除去するため物質の浸透性が良く抗体染色等に優れていると言えます。
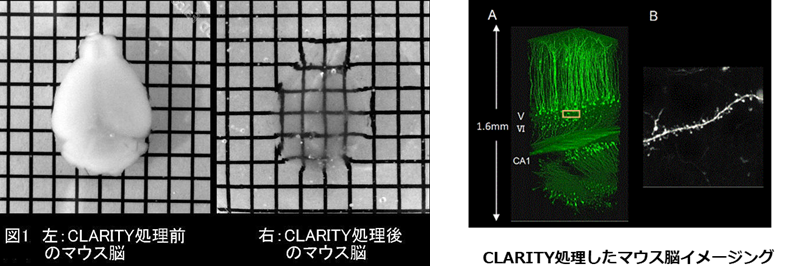
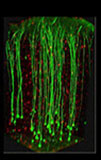
データ引用元:Chung, K et al. : Nature., 497, 332 (2013).
3.透明化技術の使い分け
透明化した組織の3次元蛍光イメージングを行う際は、目的に応じた適切な透明化技術の選択が重要ですが、それぞれの特長を理解することで、最適な透明化技術を選択することが可能です。
全脳イメージングを行う場合には、簡便で再現性の高いCUBIC法が最適です。CUBIC法での透明化によるサンプルの脆弱や透明度の不足が問題になるときは、CLARITY法も有効です。ただし、CLARITY法でもCUBIC法でもサンプルの膨潤は避けられません。また、これらの方法を用いた全脳イメージングでは、通常の共焦点顕微鏡では多大な時間を要するうえ、高解像度のイメージングは事実上不可能です。一方、超解像度顕微鏡やライトシート顕微鏡を使用すれば、迅速なイメージングが可能になりますが、高屈折率の透明化サンプル観察時には十分な分解能を得られません。また、CUBIC法やCLARITY法では透明化ステップでサンプルが膨潤するため、微細構造が必ずしも保持されていません。このことから、CUBIC法やCLARITY法は微細構造の観察よりも細胞レベルや軸索束レベルのイメージングに向いていると言えます。
一つ一つの軸索や樹状突起まで (0.5~数 μm) 定量的に解析する場合は、透明化ステップでサンプルの膨潤や収縮が起こらないSeeDB2が最適です。SeeDB2で観察する場合は、ライトシート顕微鏡よりも共焦点顕微鏡や二光子励起顕微鏡での観察が推奨されます。しかし、深さ3,4 mmを超えると単一の軸索を観察することは難しくなるため、適切な向きの脳スライス作製や、神経細胞をまばらに標識するなどの工夫が必要です。また、樹状突起スパインなどさらに細かい構造 (0.2~1 μm) を観察する場合は、二光子励起顕微鏡ではなく一光子励起の共焦点顕微鏡での観察が推奨されます。ただし、共焦点顕微鏡を使用して高解像度のイメージングを行うためには深さを犠牲にせざるをえないため、脳スライスで観察することが推奨されます。
Scale法は透明化能力と組織構造保持力がCUBIC法とSeeDB2法の中間に位置付けられます。そのため、SeeDB2法を用いるほど微細構造を観察する必要はない場合、あるいは試験的に透明化を実施する場合にはScale法が適しています。また、Scale法を用いてオルガノイドやスフェロイドも簡単に透明化可能です。
このほかにも、CUBIC法を用いたマウス全身や甲殻類の透明化や植物の透明化 (ClearSee™) など、目的に合わせて使用できる様々な透明化技術があります 。
Selection Guide
| 組織透明化技術 | Scale法 (ScaleS法) |
CUBIC法 | SeeDB2法 | CLARITY法 | ClearSee法 |
|---|---|---|---|---|---|
| 観察対象 | 全脳~脳切片 オルガノイド・スフェロイド |
全脳~脳切片 脳以外の組織 骨(要脱灰処理) |
脳切片 オルガノイド・スフェロイド |
全脳~脳切片 脳以外の組織 骨(要脱灰処理) |
植物組織 |
| 組織の構造保持力 | 高い | 一時的に膨張 | とても高い (伸縮しない) |
一時的に膨張 | 高い |
| アプリケーション | 蛍光タンパク質 蛍光色素染色 免疫染色 |
蛍光タンパク質 蛍光色素染色 免疫染色 |
蛍光タンパク質 蛍光色素(褪色に注意) |
蛍光タンパク質 蛍光色素 免疫染色 |
蛍光タンパク質 蛍光色素 |
| 操作の煩雑さ | とても簡便 | とても簡便 | 簡便 | 非常に煩雑 | 簡便 |
| 操作時間 | 透明化のみ:約1日 (2 mm厚 脳切片) |
約10~15日 (マウス全脳) |
約3~5日 (2 mm厚 脳切片) |
約1週間 (2 mm厚 脳切片) |
1~2日(根) 4~7日(葉・幼植物) 4週間(めしべ/ 成熟組織) |
| 観察時屈折率 | RI=1.47(SCALEVIEW-S4) RI=1.49(SCALEVIEW-SMt) |
RI=1.49 | RI=1.46(SeeDB2G) RI=1.52(SeeDB2S) |
RI=1.45 | RI=1.41 |
| 使用顕微鏡例 | 共焦点/二光子顕微鏡 | ライトシート顕微鏡 | 二光子/超解像度顕微鏡 | ライトシート顕微鏡 | 共焦点/二光子顕微鏡 |
4.おわりに
本稿では、脳の透明化に焦点を当てて各手法を説明してきました。生体組織だけでなく、植物など様々な分野において立体構造を捉えることは必須となりつつあります。そのため組織透明化の手法は今後ますますの発展が期待されます。
参考文献
- Hama, H. et al. : Nature Neuroscience, 14, 1481 (2011).
- Hama, H. et al. : Nature Neuroscience, 18, 1518 (2015).
- E. A. Susaki. et al. : Cell, 157(3), 726 (2014).
- K. Tainaka. et al. : Cell, 159(4), 911 (2014).
- Ke, et al. : Cell Reports, 14, 2718 (2016).
- Chung, K. et al. : Nature, 497, 332 (2013).
- 今井猛 : 生化学、87(2)、225 (2015).