【総説】CTGFとSTAT3を介した腫瘍間質反応による肝癌増大進展メカニズム
本記事は、和光純薬時報 Vol.92 No.4(2024年10月号)において、大阪大学大学院医学系研究科 消化器内科学 牧野 祐紀、疋田 隼人様に執筆いただいたものです。
はじめに
結合組織増殖因子(connective tissue growth factor ; CTGF/CCN2)はCCN (CCN1-6)ファミリータンパクに属する細胞外マトリックスタンパクである。CTGFは種々の細胞から分泌され細胞外マトリックス中で様々な分子と相互作用を来たすほか、受容体を介して細胞間のシグナル伝達に関与し、細胞接着、遊走、増殖、分化、細胞外マトリックスタンパク産生など様々な生物学的機能を発揮し、生理的条件下では臓器の発生に関与する1)。病理学的には肺、心臓、肝臓、腎臓など様々な臓器の組織リモデリングに関与しており2)、線維化の中心的メディエーターとして知られる一方、種々の腫瘍性疾患の病態にも関連することが報告されている。
肝細胞癌は肝炎ウイルス、アルコール、脂肪肝などを背景とする慢性肝疾患から発生する悪性腫瘍であり、本邦におけるがん死亡の第5位を占める難治癌である。これまで肝細胞癌の癌組織中ではCTGFが過剰発現していることが知られていた。またCTGFは癌細胞に直接的に作用してDNA合成、細胞周期の進行、浸潤・遊走能を亢進させるほか、癌関連線維芽細胞の増殖やマクロファージの遊走能を亢進させるなど、腫瘍間質細胞への作用も報告されている。一方、これらの報告はほとんどがin vitroにおける検討であり、in vivoにおけるCTGFの意義はほとんど明らかになっていなかった。CTGFは細胞外マトリックスタンパク中において作用する分子であり、その役割の理解のためには生体レベル、特に発癌モデルを用いた検討が重要である。そこで我々は肝発癌モデルマウスを用いて細胞特異的CTGF欠損肝発癌モデルを作製し、肝癌微小環境におけるCTGFの病態進展における意義について検討した3, 4)。
Kras変異肝発癌モデルおけるCTGFとSTAT3の活性化
まず肝発癌モデルマウスとして肝細胞特異的Kras変異モデル(Alb-Cre KrasG12D ; KrasG12Dマウス)を用い、CTGFの発現について検討した。ヒトの肝細胞癌においてKras遺伝子の変異は稀であるが、下流のRasシグナルが恒常的に活性化していることが知られている。本モデルはRas経路の活性化による肝発癌を想定したモデルであり、ほぼ全個体においてヒト肝細胞癌に酷似した肝癌を自然発症する。また本モデルの肝癌組織中では、癌細胞のみならず肝星細胞、血管内皮細胞、マクロファージ、T細胞など種々の間質細胞が存在し、ヒト肝細胞癌と同様に複雑な微小環境が形成されている。
我々は本モデルの癌組織において、非癌部肝組織に比しCTGFが高発現していることを見出した。癌組織のシングルセルRNAシークエンスを用いた解析において、主に癌細胞、血管内皮細胞、肝星細胞がCTGFを発現していた。また癌組織ではCTGFとともにSignal transducer and activator of transcription 3 (STAT3)がリン酸化により活性化されていることも明らかとなった。STAT3は通常細胞質内に存在するが、サイトカインや成長因子の刺激を受けてJanus kinase (JAK) によりリン酸化され、ホモ二量体またはヘテロ二量体を形成して核内移行し、転写因子として作用する5)。STAT3を活性化する因子として、様々な液性因子が知られているが、KrasG12Dマウスの癌組織中ではInterleukin-6 (IL-6)、Leukemia Inhibitory Factor (LIF)、Oncostatin M (OSM)をはじめとする種々のIL-6ファミリー分子の発現が上昇していた。シングルセルRNAシークエンスにおいてこれらIL-6ファミリー分子は主に肝星細胞、マクロファージ、血管内皮細胞などの間質細胞が発現していた。
肝癌細胞におけるCTGFの欠損による肝癌の増大抑制とSTAT3活性化抑制
シングルセルRNAシークエンスにおいて肝癌細胞がCTGFを発現していたことから、次に肝(癌)細胞特異的にCTGFを欠損させた(Alb-Cre KrasG12D CTGFfl/fl)(図1)。その結果、肝癌組織中におけるCTGFの遺伝子発現量はCTGF野生型KrasG12Dマウスの癌組織に比し約3割程度まで低下した。このことから、肝癌組織中において肝癌細胞がCTGFの最も主要な産生源であることが示唆された。このCTGF欠損KrasG12DマウスではCTGF野生型KrasG12Dマウスに比し腫瘍個数・腫瘍径が有意に小さかったことから、CTGFは肝癌の増大進展に促進的に作用していることが生体レベルで示された。さらに興味深いことに、同マウスの癌組織では各種IL-6ファミリー分子の発現が低下するとともに、リン酸化STAT3の発現低下を認めた。
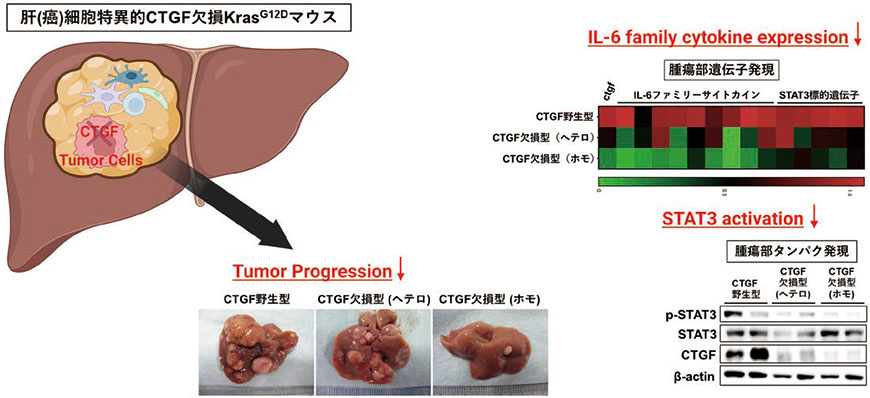
図1.肝癌細胞におけるCTGF の欠損による肝癌増大進展抑制
(文献4 をもとに一部改変)(Created with BioRender.com)
肝癌細胞におけるSTAT3の欠損による肝癌の増大抑制とCTGF発現抑制
STAT3は様々な癌腫において活性化しているが、概して腫瘍の増大進展に促進的に作用すると考えられている5)。肝細胞癌においても約60%の症例でSTAT3の活性化が認められ、肝癌細胞の増殖、浸潤、遊走を促進することがin vitroの検討により報告されてきた。一方でin vivoにおけるSTAT3の意義に関する報告は乏しく、肝発癌・増大進展におけるSTAT3の意義は十分に解明されていなかった。また肝細胞癌においてSTAT3が活性化する機序も不明であった。そこで我々はKrasG12Dマウスにおいて肝(癌)細胞特異的にSTAT3を欠損させ(Alb-Cre KrasG12D STAT3fl/fl)、肝癌におけるSTAT3の意義について肝発癌モデルにおける検討を行った(図2)。その結果、腫瘍形成率に差を認めなかったものの肝(癌)細胞特異的STAT3欠損KrasG12Dマウスでは腫瘍数、腫瘍径が減少したことから、STAT3は肝癌の増大進展に促進的に作用していることが示された。興味深いことに、このSTAT3欠損KrasG12Dマウスの癌組織では、STAT3野生型KrasG12Dマウスの癌組織に比しCTGFの発現が有意に低下していることを見出した。
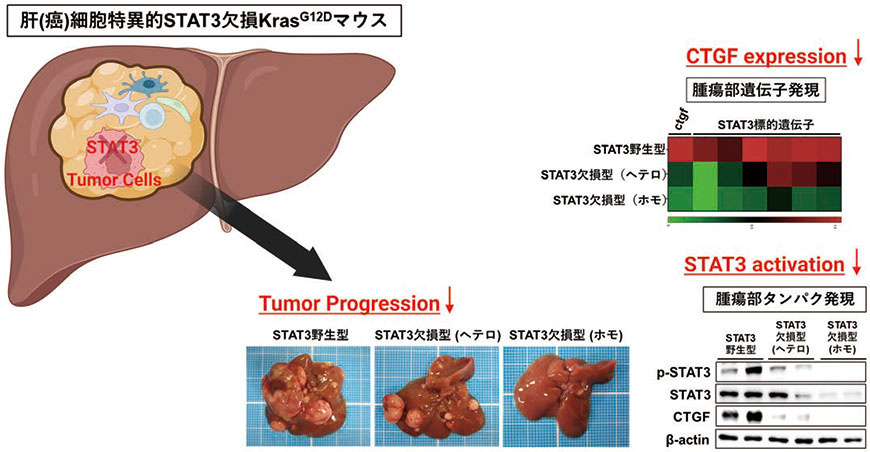
図2.肝癌細胞におけるSTAT3 の欠損による肝癌増大進展抑制
(文献4 をもとに一部改変)(Created with BioRender.com)
肝癌細胞と肝癌間質細胞との腫瘍間質反応によるCTGF発現誘導とSTAT3活性化
STAT3欠損KrasG12Dマウスの癌組織でCTGFの発現が低下したことを受け、 in vitro においてsiRNAにより肝癌細胞株のSTAT3をノックダウンしたが、CTGFの発現は低下しなかった。そこで、肝癌細胞におけるCTGFの発現は間質細胞からのパラクライン刺激により制御されている可能性を考え、肝癌細胞株を肝星細胞、マクロファージ、T細胞、血管内皮細胞の各細胞株とそれぞれ共培養したところ、単独培養時に比し肝癌細胞株のCTGF、リン酸化STAT3の発現はともに上昇した。各種間質細胞株との共培養時において肝癌細胞株のSTAT3をノックダウンすると、CTGFの発現が低下した。一方、共培養時において肝癌細胞株のCTGFをノックダウンすると、リン酸化STAT3の発現が低下した。各種間質細胞株に対しリコンビナントCTGFを添加すると、各種IL-6ファミリー分子の発現が上昇した。一方、肝癌細胞株に対しIL-6ファミリー分子(IL-6、LIF、OSM)のリコンビナントタンパクを添加すると、リン酸化STAT3とCTGFの発現が上昇した。これらの結果から、肝癌細胞の産生・分泌するCTGFが肝癌間質細胞のIL-6ファミリー分子の発現を促し、肝癌間質細胞から分泌されたIL-6ファミリー分子が肝癌細胞に作用してCTGFの発現とSTAT3の活性化を促進しているものと考えられた。
CTGFとSTAT3を介した腫瘍間質反応による肝癌細胞の増大進展
siRNAにより肝癌細胞株のCTGFまたはSTAT3をノックダウンしても、単独培養下においては細胞増殖に変化を認めなかった。肝癌細胞株と各種間質細胞株を共培養すると、肝星細胞、マクロファージ、T細胞、血管内皮細胞いずれの間質細胞株と共培養した場合においても肝癌細胞の細胞増殖は亢進した。間質細胞株との共培養時において肝癌細胞株のCTGFまたはSTAT3をノックダウンすると、いずれをノックダウンした場合においても肝癌細胞の細胞増殖は抑制された。肝癌細胞株にリコンビナントCTGFを添加しても細胞増殖に変化を認めなかったが、IL-6ファミリー分子(IL-6、LIF、OSM)のリコンビナントタンパクを添加すると、細胞増殖は亢進した。以上の結果から、肝癌細胞におけるCTGFとSTAT3は、間質細胞の存在下において肝癌細胞の増殖に促進的に作用していることが示唆され、CTGFの刺激により間質細胞の分泌するIL-6ファミリー分子が肝癌細胞の増殖を促しているものと考えられた。
ヒト肝細胞癌切除検体におけるCTGFの発現と臨床的意義
ヒト肝細胞癌切除検体93例を対象として臨床検体におけるCTGFの発現について検討を行ったところ、癌部肝組織では非癌部肝組織に比しCTGFが高発現していた。さらに癌部におけるCTGFの発現量と臨床腫瘍因子との関連について検討すると、CTGF高発現症例は腫瘍マーカー(AFP、PIVKA-Ⅱ)、腫瘍個数、門脈浸潤陽性率が高値であり、CTGFの発現量は腫瘍悪性度と関連していることが示唆された。また癌組織を用いたシングルセルRNAシークエンスでは、主に癌細胞、肝星細胞、血管内皮細胞がCTGFを発現していることが明らかとなった。一方IL-6ファミリー分子は各種間質細胞を中心に発現しており、KrasG12Dマウスにおける結果と同様であった。またThe Cancer Genome Atlas (TCGA)データベースを用いた解析では、肝癌組織中のCTGF発現量は各種IL-6ファミリー分子およびSTAT3標的遺伝子の発現量と有意な正の相関を示した。
これらの結果から、CTGFは肝細胞癌において肝癌細胞を中心として高発現しており、肝癌細胞から産生・分泌されるCTGFは肝癌微小環境中に存在する間質細胞に作用し、間質細胞からIL-6ファミリー分子の発現を誘導することが示された。間質細胞から産生・分泌されたIL-6ファミリー分子は肝癌細胞のSTAT3を活性化し、CTGFの発現を誘導するとともに細胞増殖を亢進させることが明らかとなった(図3)。
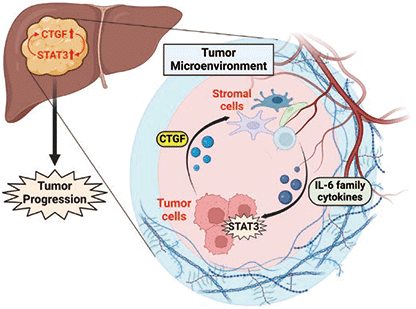
図3. CTGF とSTAT3 を介した腫瘍間質反応による肝癌増大進展機序
(Created with BioRender.com)
このようにCTGFは腫瘍間質反応のメディエーターとして機能し、肝細胞癌の増大進展を促進している分子であり、肝細胞癌に対する有望な治療標的になり得ると考えられる。CTGFの治療標的としての意義はこれまで複数の線維性・腫瘍性疾患において知られており、阻害剤として中和抗体Pamrevlumabが開発され、既に臨床試験が行われている6)。重要なことに、肝細胞癌は多くの場合慢性肝疾患に伴う肝線維化を背景として発生するが、CTGFは肝癌の増大進展とともに肝線維化への関与も示唆されている2)。肝線維化の進行は肝予備能の低下に密接に関連するため、肝細胞癌患者において腫瘍の制御とともに線維化のマネジメントは重要な意味をもつ。そのため、CTGFを標的とした治療は肝癌と肝線維化の両者を抑制する革新的な治療法となる可能性がある。今後は肝細胞癌に対してもCTGFを標的とした新規治療開発が進み、難治癌の予後向上へと繋がることが期待される。
参考文献
- Jun, J.I. et al. : Nat. Rev. Drug Discov., 10, 945 (2011).
- Kodama, T. et al. : J. Clin. Invest., 121, 3343 (2011).
- M akino, Y. et al. : Cancer Res., 78, 4902 (2018).
- Makino, Y. et al. : Cell Mol. Gastroenterol.Hepatol., 15, 99 (2023).
- Yu, H. et al. : Nat. Rev. Cancer, 14, 736 (2014).
- Raghu, G. et al. : JAMA., 332 (5), 380 (2024)




