【総説】構造保持性・蛍光保持性・抗原保持性に優れた新規組織固定液―FM Fix―
本記事は、和光純薬時報 Vol.93 No.4(2025年10月号)において、
名古屋大学医学部附属病院・腎臓内科・講師 古橋 和拡様に執筆いただいたものです。
1 はじめに
組織固定とは、生体内での状態を静的に保存し、生体外で観察可能にするための手段である。生体組織は生体外に取り出した瞬間から生体内での情報を失い始めるが、組織固定により、細胞の形態や組織構造、タンパク質の発現量および分布といった生体情報を長期間保持することが可能となった。また、組織標本の作製過程では、各種試薬による処理、温度変化、pH変化といった工程を経るが、あらかじめ適切な固定を行うことで、こうした操作による組織の変性や変形を最小限に抑えることができる。このような理由から、固定液の登場によって顕微鏡を用いた詳細な組織の観察が可能となり、組織学や病理学を中心に科学は大きく発展してきた。
これまで最も広く利用されてきた固定剤はホルムアルデヒドであり、一般的には10%中性緩衝ホルマリン (NBF) や4% paraformaldehyde (PFA) として用いられる場合が多い。10%NBFは光に対する安定性が高く利便性に優れるが、酸化によりギ酸を生成してpHが低下し、固定力の低下や、ホルムアルデヒドの重合を引き起こすため、安定化剤としてメタノールが添加されている。一方で、4%PFAは重合ホルムアルデヒドから調製された固定液で、安定化剤は含まれていないが、紫外線や酸素により劣化しやすいという欠点がある。
近年、顕微鏡や蛍光タンパク質などのイメージング技術が著しく発展する中で、10%NBFや4%PFAといった従来の固定液にはいくつかの課題が指摘されている。固定液はタンパク質の官能基に作用し、分子内や分子間で架橋を形成することにより、分子の立体構造に変化を引き起こすが、その結果、抗体の結合部位であるエピトープの高次構造が変化して抗体との結合が阻害されたり、蛍光タンパク質の変性によって蛍光シグナルが減弱したりする可能性がある。実際に、ホルマリン固定によりタンパク質が架橋されることで、タンパク質のフォールディングが変化したり、物理的に組織が収縮したりすることが指摘されている。そのため、固定後に得られる情報は必ずしも in vivoの実態と完全に一致するとは限らず、観察される構造やシグナルは、使用する固定液の種類や条件に大きく左右される。こうした問題は、近年注目を集めている組織透明化の分野においても極めて重要となってくる。従来、組織の三次元構造を解析するには、連続切片を用いた二次元画像の再構成が一般的であった。一方、組織透明化技術では、固定された組織を透明化することで光の吸収や散乱を低減させ、蛍光色素や蛍光タンパク質と組み合わせることで、組織や臓器を三次元的に、かつ形態を損なうことなく深部まで可視化できるようになった。組織透明化においては、組織の透明度が高いほどより深い深度まで観察が可能になるが、同時に蛍光タンパク質のシグナル保持やエピトープの抗原性、組織の微細構造の維持も非常に重要であるため、その両者を満たすサンプルを作成するために、観察する組織の特性に応じた多様なプロトコールが開発されている。このように、組織固定はもはや組織標本作成のための単なる手段にとどまらず、得られる科学的知見の質そのものを左右する重要な要素となるため、目的とする実験系に最適な固定液を選択するための検討や、新規固定液の開発は現在も精力的に行われている。
新規の固定液であるFM Fixは、構造保持性・蛍光保持性・抗原保持性に優れた固定液であり、組織学的解析から細胞レベルの定量解析に至るまで幅広い応用が可能であると考えられ、本稿では、イメージング技術への応用可能性について紹介する。
2 FM Fixの構造保持性
固定液の構造保持性に関して、ホルマリンやパラフォルムアルデヒドでは組織収縮が起こることが知られている。しかし、日常的に組織のみを観察する研究者や臨床医は、その収縮した状態が通常であると認識していることが多い。我々も、実際に生態顕微鏡で生きた状態の血管構造を見ることで、はじめて固定液による収縮具合を認識できた。マウスの生体顕微鏡では腎臓尿細管周囲には血管が存在するスペースを多く認めることから、実際の組織では尿細管周囲には血管スペースが存在する。しかし、生体外で組織を観察するためにホルマリンやPFAの固定を行うと組織収縮のため血管内腔のスペースが消失し、血管の壁と壁が接着し線状に観察される。一方で、FM Fixでは組織収縮が生じにくく、血管内腔のスペースが維持され、生体顕微鏡に近い構造を維持した状態で画像を取得することができる(図1)。このFM Fixの組織構造保持性を活かし、我々は骨髄において新たな毛細血管を発見し、骨髄の三次元イメージングから血管が形成する造血幹細胞ニッチの特性を解明することに成功した1)。
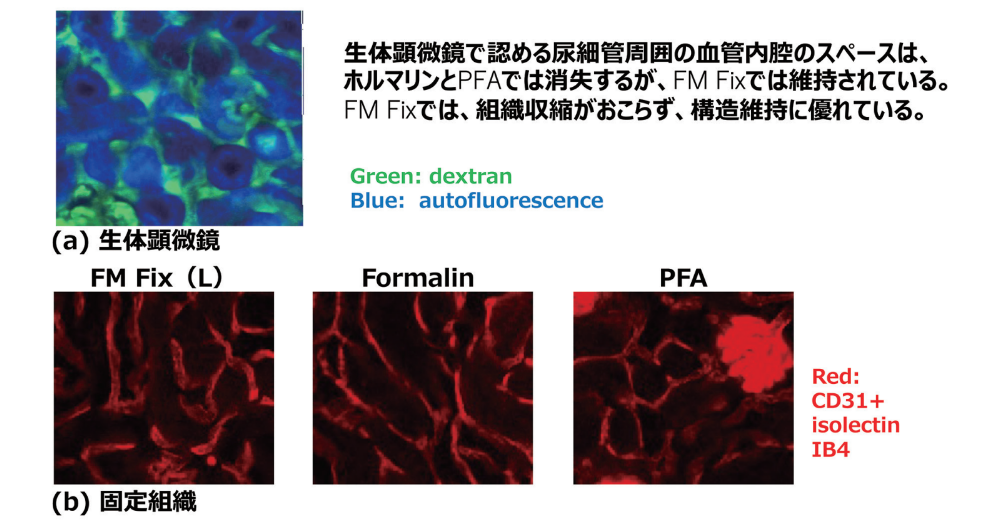
図1.FM Fixの構造保持性
3 FM Fixの蛍光保持性
最近のイメージング研究において、レポーター遺伝子を用いた研究は、細胞や機能蛋白の検出から細胞系譜解析にまで幅広く使用されている。これらの解析において、発現蛋白量が少なくても蛍光蛋白を検出できる固定液が、標的蛋白の検出感度を決める重要な要素となる。蛍光蛋白は立体構造の変化から蛍光強度が減弱することが知られており、蛋白構造の維持に優れた固定液が、Green Fluorescent Protein(GFP)の蛍光強度を維持できる最良の固定液となる。FM Fixは、固定組織において良好なGFP検出を達成しており(図2a)、さらにフローサイトメトリーではPFAやホルマリンよりも良好な蛍光維持を達成し、生細胞とほぼ同等のGFP蛍光強度の維持を実現している(図2b)。GFP以外にも tdTomato、RFPでも良好な検出が可能である。
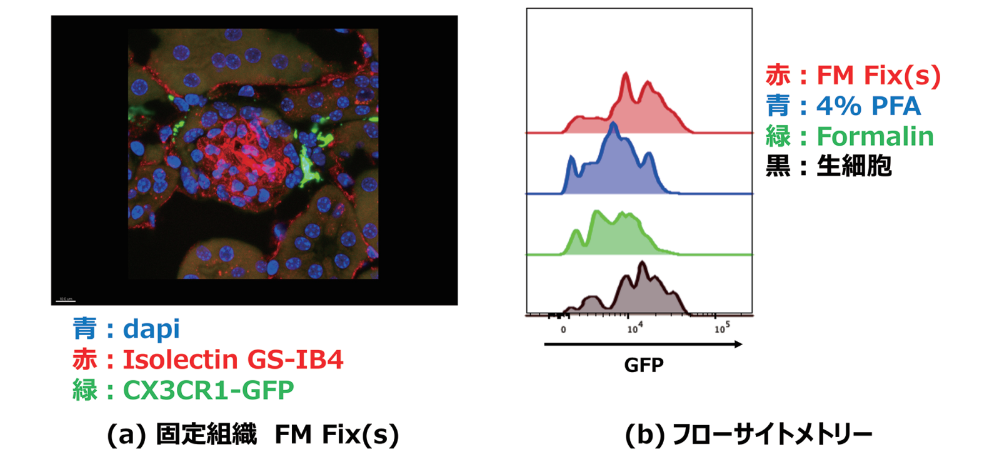
図2. FM Fixの蛍光保持性
4 FM Fixの抗原保持性
固定液に伴うタンパク質の架橋から蛋白構造の変化が生じ、抗体による抗原認識が妨げられることがある。そのため、蛋白によっては抗原の賦活化が必要とされることがある。さらに検出が難しい場合には、抗原検出のために多くの抗体を試す必要に迫られ、時には抗原の検出を諦めることもある。そのため、最もイメージングで汎用される抗原抗体法による抗原の検出のしやすさは、実験そのものをスムーズに進め、研究内容の充実にもつながる。
今回、我々は全身性エリテマトーデスの患者腎生検を用いて、IgG、IgA、IgM、C1q、C3、C4の検出を抗体により行った。本疾患では、これらすべての抗原が糸球体に沈着することが知られており、通常は凍結未固定サンプルを薄切し、アセトンで固定後に染色を1次抗体により行う。今回はアセトンを、FM Fix(s)、PFA、ホルマリンに置換し、抗原検出に与える影響を評価した。FM Fix(s)は、PFA、ホルマリンに比較して良好な抗原性の保持を示した(図3)。このことより、FM Fixは抗原への影響が少なく、抗体による抗原検出にも優れていることが示唆された。
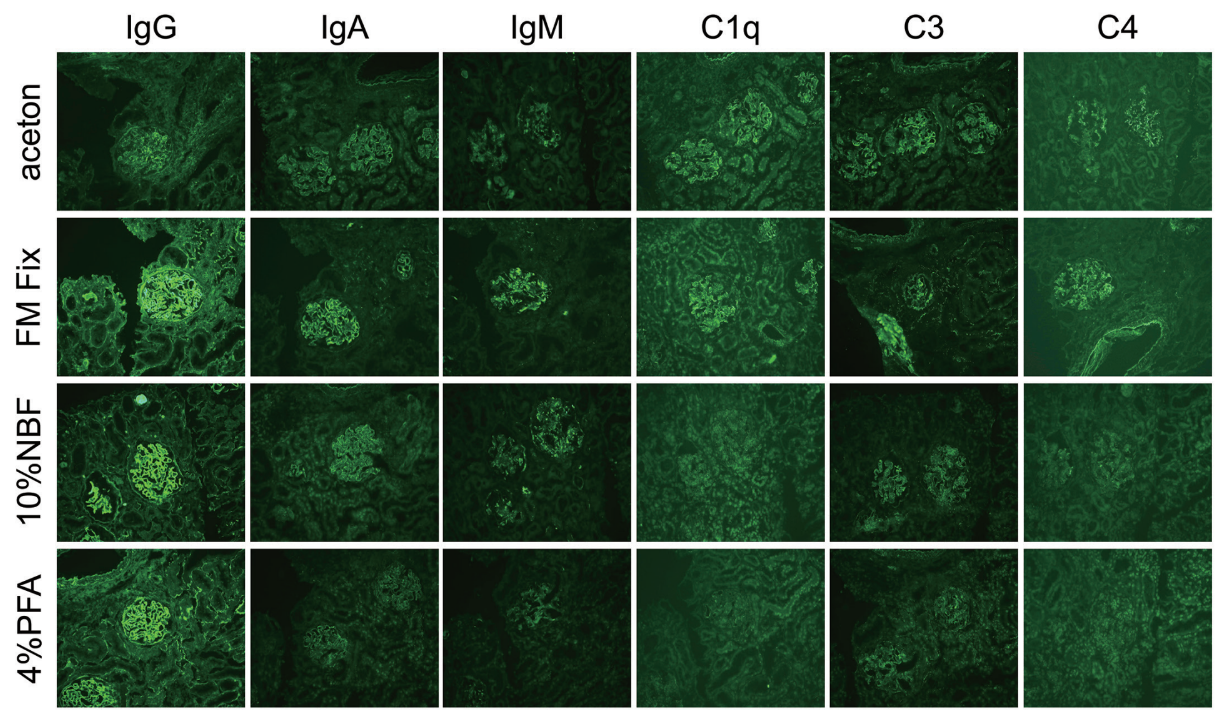
図3. FM Fixの抗原保持性
5 FM Fixの組織透明化との相性の良さ
現在、最新のイメージング技術として組織透明化が注目されている。組織を透明化し、三次元イメージングを取得することにより、血管や神経を連続的に評価することが可能となり、細胞間ネットワークを詳細に解析することが可能となった。
今回、FM Fixの組織透明化との相性を評価した。FM Fixで固定した腎臓を、FM Fix(L)、PFA、ホルマリン、アセトンで固定した後に、SeeDB2で透明化処理を行った。肉眼的観察において、FM Fixは、PFA、ホルマリン、アセトンより良好な組織透明化を達成した(図4a)。さらに、FM Fixは構造保持性・蛍光保持性・抗原保持性に優れていることから、Optical clearing後の構造観察、レポーター蛋白観察、抗体染色においても優位性を示すことが期待される。実際に我々は、FM Fix(L)により腎臓を固定し、SeeDB2による透明化から血管の連続性の明瞭な描出とレポーター蛋白tdTomatoによる血管周囲細胞の血管との明瞭な位置関係を同時に検出することに成功した(図4b)。
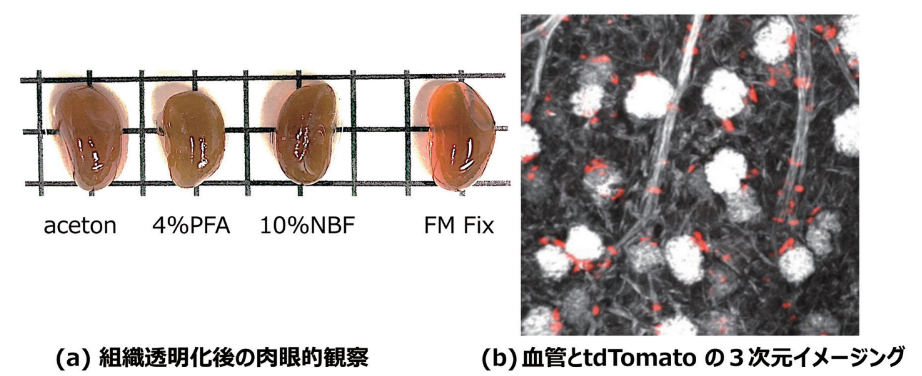
図4. FM Fixの組織透明化との相性の良さ
6 展望
新規の固定液であるFM Fixは、構造保持性・蛍光保持性・抗原保持性に優れた固定液であり、その応用例を示した。今後、FM Fixは、その蛋白構造維持の優位性から、新たなイメージング法や解析そのものを生み出す可能性を秘めている。さまざまなイメージング研究・蛋白研究・臨床分野でその応用が期待される。
参考文献
- Furuhashi, K., Fujisaki, J. et al. : Nature, 638, 206 (2025).




