【ラボの扉をひらく~抗体医薬ベンチャー 研究最前線~】第1回 間質・微小環境改善による難治性疾患治療薬の開発(ペリオセラピア株式会社)



抗体医薬ベンチャー企業のご研究内容をより深堀りしてお伝えする本連載企画。記念すべき第1回はペリオセラピア株式会社のご研究内容の紹介になります!
ペリオセラピア株式会社は2017年10月に設立された大阪大学発のベンチャー企業です。未だ治療薬のない難治性疾患に対して抗体治療薬の開発を通じて、「難病に苦しむ患者とその家族を笑顔にする」ため、日々ご研究を続けられております。
また、開発中の抗体医薬品の社会実証として、AMED創薬ベンチャーエコシステム強化事業の支援を受け、本年3月より、大阪大学医学部付属病院医師主導試験を開始されています。
間質・微小環境改善による難治性疾患治療薬の開発
ペリオセラピア株式会社
代表取締役社長 田原 栄治 様
1) はじめに
300種類を超える難治性疾患は、発症メカニズムの不明確さ、治療法の未確立、患者数の少なさといった要因により、長らく創薬開発の主流から外れてきた。しかし近年では、AI、バイオ医薬品、個別化医療といった先端技術の進展に加え、公的機関による支援や産学連携の強化により、難治性疾患に対する創薬はかつてないスピードで進み、具体的な成果も現れつつある。それでもなお、病態の複雑性や開発の高い難易度が障壁となり、依然として多くの課題が残されている。こうした状況の中で、一人でも多くの難病患者に新たな治療の選択肢と希望を届けるべく、さまざまな挑戦が続けられている。
当社は、大阪大学医学系研究科において得られた学術的知見および特許を基盤とし、数ある難治性疾患の中でも、特に若年女性に多く発症し、社会的課題として注目されている「化学療法抵抗性乳がん」に着目している。本疾患に対する新たな治療法として、抗体医薬の開発を最優先で進めており、その概要と創薬における取り組みについて、本稿で紹介する。
2) 乳癌治療薬の現状と課題
乳がん治療は、医療技術の進歩により個別化が進み、分子標的薬の導入によって多くの患者の予後が改善している。しかし、依然として解決すべき課題は多く、さらなる研究と治療戦略の構築が求められている。乳がんは、ホルモン受容体(ER/PR)、HER2、Ki67などの発現に基づき、ルミナルA/B、HER2陽性、トリプルネガティブ(TNBC)など複数のサブタイプに分類される。各サブタイプに応じて治療法が異なるため、患者ごとに最適な治療を選択する必要がある。一方で、化学療法、ホルモン療法、HER2標的療法に対する薬剤耐性の獲得は依然として大きな課題であり、その耐性メカニズムを解明し、克服することが喫緊の課題となっている。さらに、乳がんは遠隔転移を起こしやすく、治療を繰り返す中で薬剤耐性を獲得しやすいため、根治が困難なケースも多い。現在の治療目標は、病勢の進行を抑えつつ、生活の質(QOL)を維持することに置かれている。転移・再発乳がん患者においては、予後をいかに延ばし、QOLを維持するかが重要な課題となっている。
3) 化学療法抵抗性
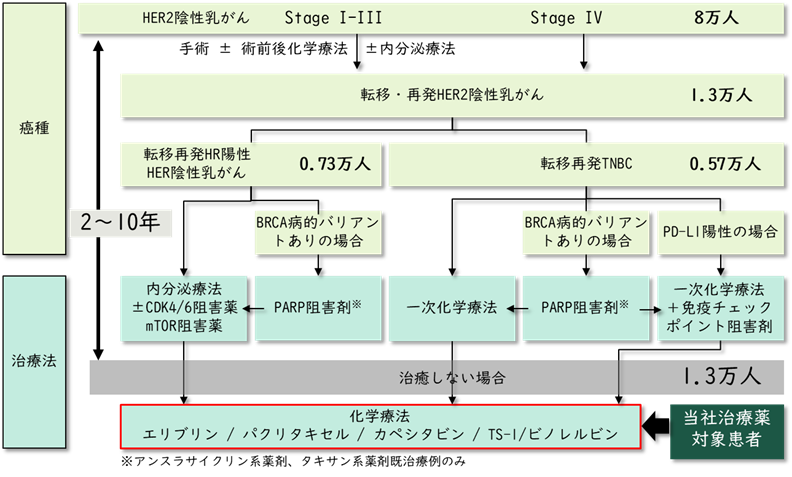
複数の化学療法レジメンを受け、それらすべてに抵抗性を示した場合、次に使用できる有効な薬剤は極めて限られる。
一部の薬剤に対して獲得された耐性が、類似の作用機序を持つ他の薬剤にも波及することがあり(交差耐性)、使用可能な治療選択肢はさらに狭まる。
加えて、耐性のメカニズムは患者ごとに異なるため、画一的な治療法では十分な効果が得られにくく、個々の患者に適した治療法を見出すことが困難な状況である。薬剤耐性のメカニズムとしては、以下のようなものが知られている。
- がん細胞が薬剤排出ポンプを発現し、薬剤の細胞内蓄積を防ぐこと
- 薬剤の標的分子が変異または過剰発現し、薬剤が結合できなくなる、あるいは結合しても効果を発揮しにくくなること
- がん細胞がDNA修復機構を強化し、薬剤による損傷を修復してしまうこと
- アポトーシス(細胞死)のメカニズムに抵抗性を獲得し、薬剤によるダメージを受けても細胞が死ににくくなること
- がん幹細胞が一般的な化学療法に対して高い抵抗性を示し、治療後にも残存して再発や薬剤耐性の原因となること
- がん細胞を取り巻く微小環境(血管、線維芽細胞、免疫細胞など)が変化し、薬剤の浸透を妨げる、あるいはがん細胞の生存や増殖を促進すること
このように、薬剤耐性の機構は多岐にわたり、相互に複雑に関与しているため、治療の大きな障壁となっている。この課題に対処するためには、耐性メカニズムを克服する新規標的の探索、免疫療法の積極的活用、さらには化学療法・分子標的薬・免疫療法・放射線治療などを組み合わせた多角的アプローチによって、治療効果の相乗作用や耐性獲得の抑制を図る必要がある。現在、これらを目指した研究開発が精力的に進められている。
4) 新たな創薬標的探索
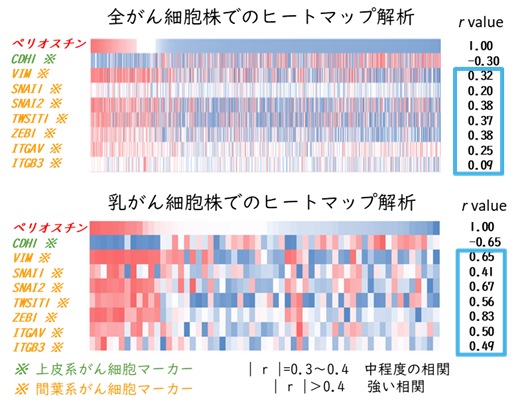
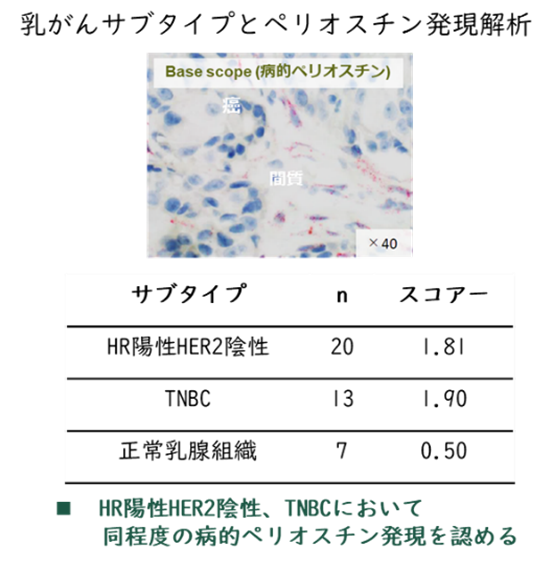
様々な化学療法や分子標的薬によって腫瘍縮小効果を示す一方で、治療抵抗性を獲得し、転移・再発する症例が生じている。なかでも、トリプルネガティブ乳がん(TNBC)は乳がん全体の約15%を占め、現時点では化学療法が治療の中心となっているが、再発リスクが高く、再発後における化学療法抵抗性が大きな課題となっている。様々な治療抵抗性の機序がある中で、当社は、治療抵抗性の有力な原因である上皮間葉転換(EMT)が関与していると考えられている。EMTは、上皮細胞が間葉系細胞の性質に変化する現象であり、生物の発生や組織修復といった生理的過程だけでなく、がんの転移や薬剤耐性獲得といった病理的プロセスにも深く関与していることが明らかになっている。特にがん治療においては、EMTを標的とした新たな治療戦略の開発が期待されている。そこで、間葉系細胞への誘導に関与する因子を探索するため、大阪大学の谷山先生と米国カリフォルニア大学サンディエゴ校のJing Yang先生との国際共同研究により、1,000例以上のがん組織検体を用いた網羅的解析を実施している。その結果、間葉系マーカーと強い相関を示す因子として、ペリオスチンを同定している。ペリオスチン遺伝子発現の解析では、様々ながんの中でもトリプルネガティブ乳がんにおいてペリオスチンの高発現が予後不良と有意に関連することを確認している。
ペリオスチン(Periostin)は、分子量約90kDaの糖タンパク質であり、細胞外マトリックス(Extracellular Matrix;ECM)を構成する分子の一つである。その構造と機能から「接着分子」に分類され、コラーゲンなどの線維性タンパク質と結合し、細胞とECMとの相互作用を仲介することで、様々な生理的および病理的プロセスに関与している。正常組織においては、恒常的な機能として、骨膜(骨の表面を覆う膜)、歯根膜(歯と顎の骨をつなぐ組織)、心臓弁、腱、靭帯、卵巣など、主に機械的ストレスが加わる組織や、組織の再構築が活発に行われる部位で高発現している。一方、病的状態においては、炎症や線維化の促進、さらにはがんの進展および転移に関与していることから、ペリオスチンは疾患のバイオマーカーや新たな治療標的として注目されている。
5) 病的ペリオスチンとは
先に述べたように、ペリオスチンは炎症や線維化の促進、がんの進展および転移に関与している。ペリオスチン遺伝子は23個のエクソンを有しており、選択的スプライシングにより4種類のバリアントが生じる。恒常的な機能を担うスプライシングバリアント(生理的ペリオスチン:Pn4)は、Exon17およびExon21を含まない。一方、病的状態に関与するバリアント(Pn1-3)は、Exon17やExon21を含んでおり、これらの領域が病理的機能に寄与していると考えられている。通常、生理的ペリオスチンは病的ペリオスチンよりも1,000〜10,000倍高く発現しているが、がんなどの病態では病的ペリオスチンの発現が顕著に増加する。ペリオスチンの疾患への関与が明らかになる中、ペリオスチンを抑制する研究が進められてきた。しかし、4種類すべてのバリアントを一括して抑制すると、生理的機能に悪影響を及ぼすことが報告されている。たとえば、生理的ペリオスチンを抑制した急性心筋梗塞モデルでは、心破裂の発生率が2倍に増加し、また、マウス担癌モデルでは肺転移の増加、トリプルネガティブ乳がん担癌マウスでは原発巣の有意な増大が観察されている。これらの結果は、生理的ペリオスチンの抑制が過度な線維化抑制を誘発し、副作用のリスクを高めることを示唆している。このような背景から、我々はExon17およびExon21を含む病的バリアントのみを選択的に抑制することが、有効かつ安全な治療戦略になり得ると考えた。
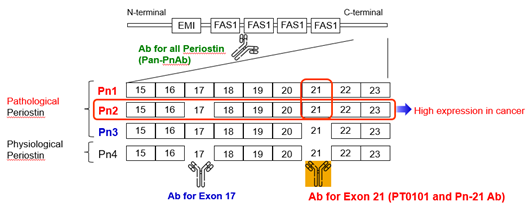
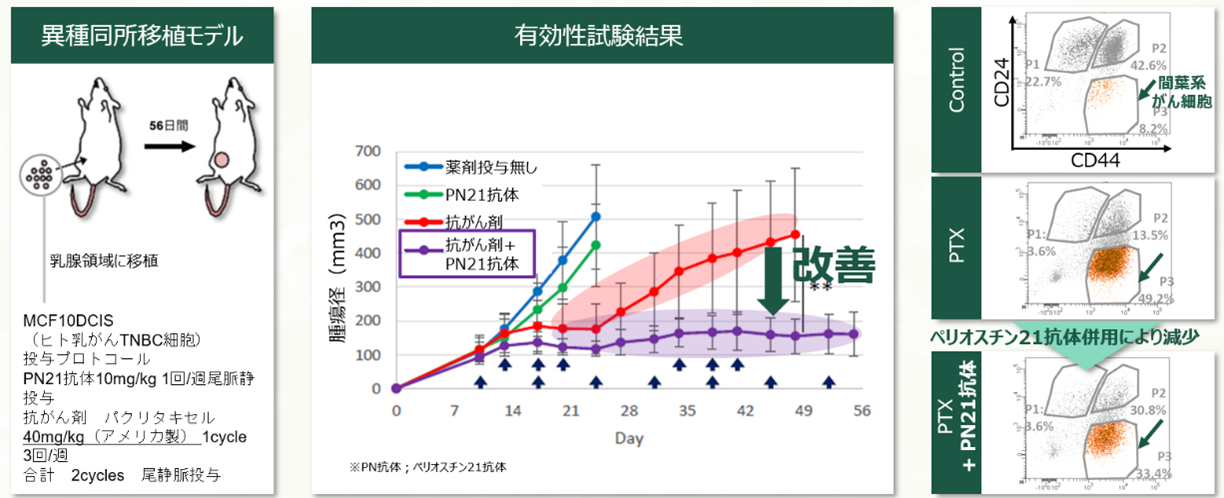
そこで、生理的ペリオスチンを抑制せず、病的ペリオスチンを特異的に標的とするため、Exon17およびExon21に対する中和抗体を作製した。Exon17を抗原とした中和抗体を用いた急性心筋梗塞ラットモデルでは、急性期の心破裂などの副作用を生じることなく、心機能の改善および梗塞巣における残存心筋の維持が確認された。さらにがん領域においては、トリプルネガティブ乳がんの化学療法抵抗性モデルマウスを用いて、Exon21を抗原とする中和抗体が転移・再発の抑制に加え、顕著な抗腫瘍効果を示すことを確認した。また、この抗体は、化学療法薬パクリタキセルと併用することで、上皮間葉転換(EMT)の抑制にも寄与することを実証している。
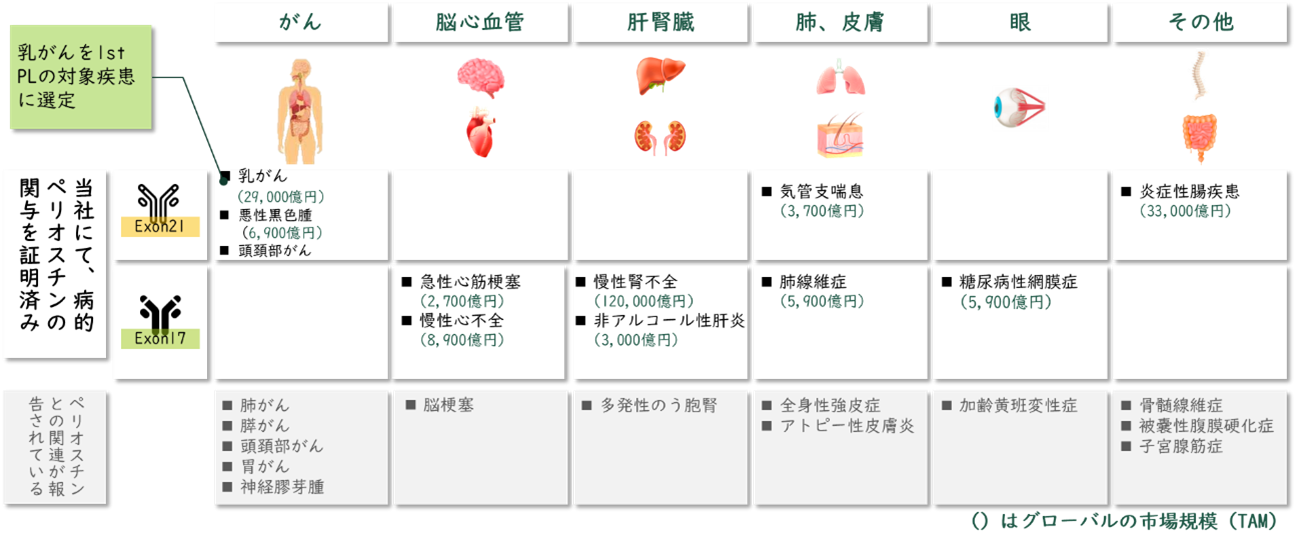
また、上述した疾患以外にも、Exon17に対する中和抗体は、急性心筋梗塞に加えて、糖尿病性網膜症における病的血管新生の抑制、急性腎不全における腎線維化の抑制、さらには肺線維症における線維化の抑制効果を示している。
一方、Exon21に対する中和抗体は、乳がんに加え、悪性黒色腫における腫瘍増殖および肺転移の抑制、頭頚部がんにおける腫瘍増殖の抑制、さらには炎症性腸疾患における線維化の抑制にも有効であることを明らかにしている。
これらの知見を踏まえ、対象となる疾患において、どの病的ペリオスチンバリアントが病態に関与しているかを見極めた上で、適切な中和抗体を選択することにより、より効果的で安全性の高い治療薬の開発につながると考えている。
6) 病的ペリオスチン抗体による治療薬の臨床開発
モデル動物を用いた研究などから、病的ペリオスチンに対する中和抗体が新たな治療薬となり得ることが示唆されており、社会的課題の一つである乳がんの転移・再発症例を対象とした臨床試験において、その安全性および有効性を評価するPhase I/IIa試験を実施することとした。現在、乳がんの転移・再発症例では、化学療法に対する抵抗性を獲得する患者が多く、特にAYA世代の女性において命を落とすケースも少なくない。これはアンメットメディカルニーズの高い疾患であり、根治が困難なことから、治療の目標は「病気の進行を抑え、症状を緩和し、患者の生活の質(QOL)をできる限り長く維持すること」に置かれている。しかし、現時点では有効な治療薬が限られているのが現状である。臨床試験の実施にあたっては、独立行政法人医薬品医療機器総合機構(PMDA)と協議を重ね、治験実施体制の構築、治験薬の製造、GLP準拠の非臨床安全性試験などを経て、臨床試験体制を整備している。本治験は、大阪大学医学部附属病院による医師主導試験として実施しており、大阪大学医学部治験審査委員会(IRB)との協議のもと、がん研究会有明病院、名古屋大学病院、大阪国際がんセンターの協力を得て、2025年3月より臨床試験を開始している。また、2026年下期には、米国におけるPhase I/IIa試験の実施に向けた準備も進めている。なお、本臨床開発は、2024年に採択されたAMED「創薬ベンチャーエコシステム強化事業」の支援を受けて実施している。
7) 今後の展望
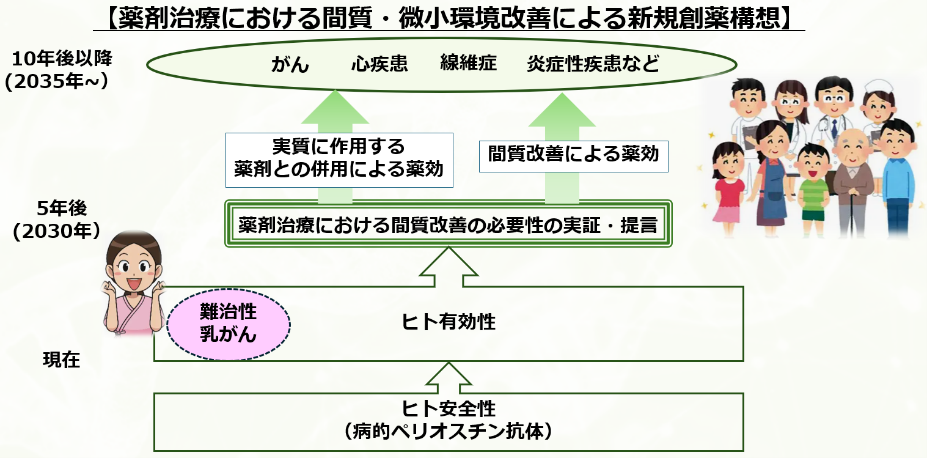
これまでの創薬開発では、疾患の実質細胞(例:がん細胞など)を標的とし、細胞増殖の抑制、細胞死の誘導、あるいはシグナル伝達の阻害を通じて、画期的な薬剤が数多く開発されてきた。しかしながら、がんにおいては延命効果にとどまる場合が多く、その他の疾患でも進行の抑制にとどまるケースが少なくない。疾患を根本的に克服するためには、既存の治療法に加えた新たな治療戦略が必要である。その一つのアプローチとして、疾患特異的な間質や微小環境の関与に着目することで、これまでにない治療の可能性が広がると考えている。現在、我々は病的ペリオスチンを抗原とする中和抗体を用いた臨床研究を実施しており、本抗体の安全性および有効性が明らかになることで、間質や微小環境の改善が新たな治療の道筋となることを期待している。特に、本抗体の安全性が確認されれば、乳がん以外のがん種や他疾患への適応拡大が可能となるだけでなく、抗体薬物複合体(ADC)などの抗体モダリティへの展開によって、これまで治療薬の開発が困難であった難治性疾患に対する新たな治療手段として貢献できると考えている。このような大きな構想を実現するためには、今後も多くの研究を継続する必要があるが、我々単独にとどまらず、他の企業や研究機関との連携を積極的に進め、一日も早く新たな治療薬を創出し、難治性疾患に苦しむ患者様とそのご家族に笑顔を届けられるよう尽力していく所存である。
参考文献
- Periostin blockade overcomes chemoresistance via restricting the expansion of mesenchymal tumor subpopulations in breast cancer Sci Rep. Nakazawa Y, Taniyama Y, Sanada F, Morishita R, Nakamori S, Morimoto K, Kay T. Yeung K T, and Yang J, 2018 Mar 5;8(1):4013. doi: 10.1038/s41598-018-22340-7.
- Expression of Periostin Alternative Splicing Variants in Normal Tissue and Breast Cancer. Kanemoto Y, Sanada F, Shibata K, Tsunetoshi Y, Katsuragi N, Koibuchi N, Yoshinami T, Yamamoto K, Morishita R, Taniyama Y and Shimazu K. Biomolecules. 2024 Aug 31;14(9):1093. doi:10.3390/biom14091093.
- The importance of suppressing pathological periostin splicing variants with exon 17 in both stroma and cancer. Shibata K, Koibuchi N, Sanada F, Katsuragi N, Kanemoto Y, Tsunetoshi Y, Ikebe S, Yamamoto K, Morishita R, Shimazu S and Taniyama Y Cells. 2024 Aug 23;13(17):1410. doi: 10.3390/cells13171410.
- Periostin as a Novel Factor Responsible for Ventricular Dilation Katsuragi N, Morishita R, Nakamura N, Ochiai T, Taniyama Y, Hasegawa Y, Kawashima K, Kaneda Y, Ogihara T, and Sugimura K Circ. 2004 Sep 28;110(13):1806-13
- Tsunetoshi Y, Sanada F, Kanemoto Y, Shibata K, Masamune A, Taniyama Y, Yamamoto K, Morishita R; Role for periostin pathological variants and its Interaction with HSP70-1a in promoting pancreatic cancer progression and chemoresistance. Int J Mol Sci. 2024, 25, 13205.
- Experimental Study: The Development of a Novel Treatment for Chemotherapy-Resistant Tongue Cancer with the Inhibition of the Pathological Periostin Splicing Variant 1-2 with Exon 21. Ikebe S, Koibuchi N, Shibata K, Sanada F, Shimizu H, Takenobu T, Taniyama Y.Cells. 2024 Aug 13;13(16):1341. doi: 10.3390/cells13161341.
本記事の内容に関するお問い合わせ
ペリオセラピア株式会社のウェブページに移動します。
記事掲載に関するご相談・関連リンク
富士フイルム和光純薬は試薬・キット、受託サービスのご提供の他、様々な情報発信により、研究者の皆様の日々の活動を応援します。