【テクニカルレポート】新規培養培地F-hiSIEC™ Culture Medium ALの開発と薬物動態研究への応用
本記事は、和光純薬時報 Vol.93 No.3(2025年7月号)において、富士フイルム株式会社 バイオサイエンス&エンジニアリング研究所 諸橋 康史様に執筆いただいたものです。
F-hiSIEC™とは
F-hiSIEC™(ヒトiPS細胞由来腸管上皮細胞)は、FFグループが保有するiPS細胞関連の技術と名古屋市立大学の松永民秀教授が持つ分化誘導技術を組み合わせて作製された細胞である1)。本細胞は、ヒト小腸に近い性質を有するため、食品や薬物の吸収、毒性評価、免疫・炎症評価2)、さらにはノロウイルス培養および消毒剤評価ができ、食品メーカー、製薬企業、アカデミア等で幅広く活用されている。
F-hiSIEC™ Culture Medium ALの製品特長
我々は、松永民秀教授の成果3)を基に、従来の培養培地の組成を変更したF-hiSIEC™ Culture Medium AL(以下、本製品)を開発した。本製品は、セルカルチャーインサート上での気液培養(Apical側 : 培地なし、Basal側 : 培地あり)に最適化した培地である。培養4日目から液液培養から気液培養に切り替えることで、小腸マーカー、トランスポーターや代謝酵素の遺伝子発現が従来法(従来の培養培地×液液培養)と比較して向上することが確認されている。バリア機能も膜透過係数Pappが各々の化合物の膜透過の性質に応じた値を示すことから、本製品で培養されたF-hiSIEC™のバリア機能は正常に機能していると考えられる (図1)。
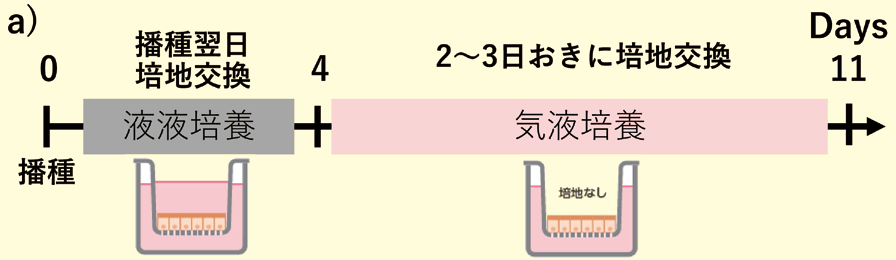
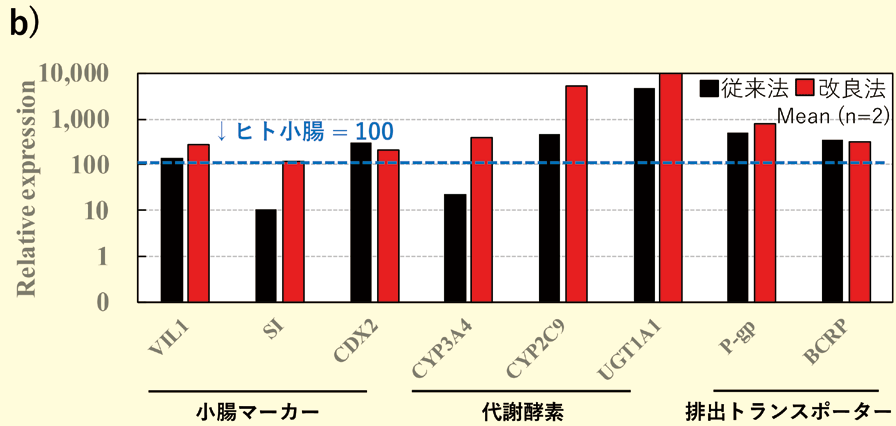
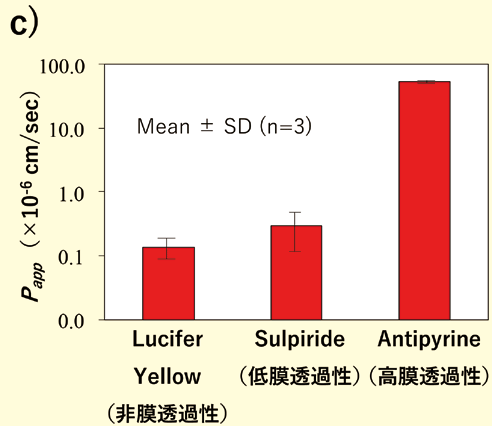
図1.
a)Culture Medium ALを使用したF-hiSIEC™ 培養法の概略図
b)F-hiSIEC™ の遺伝子発現プロファイル(従来法との比較)
c)膜透過性データ
小腸アベイラビリティ(Fg)の評価
経口投与は、その利便性から薬物の投与ルートとして最も汎用されている。経口投与された薬物が効果を示すためには、消化管吸収上皮細胞を通過し、全身循環血中に到達する必要がある。したがって、創薬において、経口薬が血中に到達する割合であるバイオアベイラビリティ(BA)の予測性向上は重要な課題である。経口薬のBAは吸収上皮細胞において膜透過した割合(Fa)、吸収上皮細胞における代謝の回避割合(Fg)および門脈から肝臓を通過する際の代謝・排泄の回避割合(Fh)で構成される(BA=Fa × Fg × Fh)。まず、動物実験によって薬物のBAを評価する手段が考えられる。動物実験は、全過程を加味したBA評価ができる反面、種差の影響により動物のBAが必ずしもヒトBAを反映しないことが知られている4)。一方で、創薬において汎用されているin vitro 評価系は、膜透過過程ではCaco-2細胞の経細胞輸送実験、肝代謝過程では、肝ミクロソームやヒト肝細胞代謝試験である。肝代謝に関してはin vitro 実験値からin vivo 値に換算する方法論が確立されており、概ね良好な相関があることが知られている5)。Caco-2細胞はセルカルチャーインサート上で極性を維持した細胞単層を形成するため、吸収上皮細胞を介した透過(Fa)を模倣できるが、吸収上皮細胞の代謝の中心を担うCYP3A4のmRNA量がヒト消化管の1/100程度であり、吸収上皮細胞における代謝(Fg)を再現することができない。したがって、ヒトFg を精度良く予測しうる実験系の開発は依然として必要であったが、近年in vitro でヒトFg を精度良く評価するための細胞として、ヒトcrypt由来分化吸収上皮細胞6)が報告された。ただし、製品として販売されておらず、誰もが容易に利用することはできない。そこで我々は、本製品によって培養されたF-hiSIEC™のFg 評価をCYP3A4の基質に対して実施したところ、良好な予測の成立が確認できた(図2)。
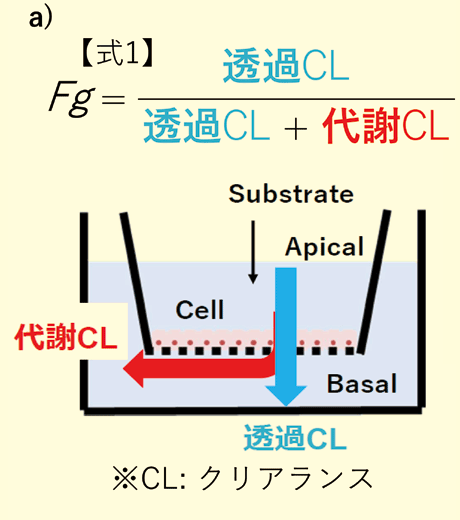
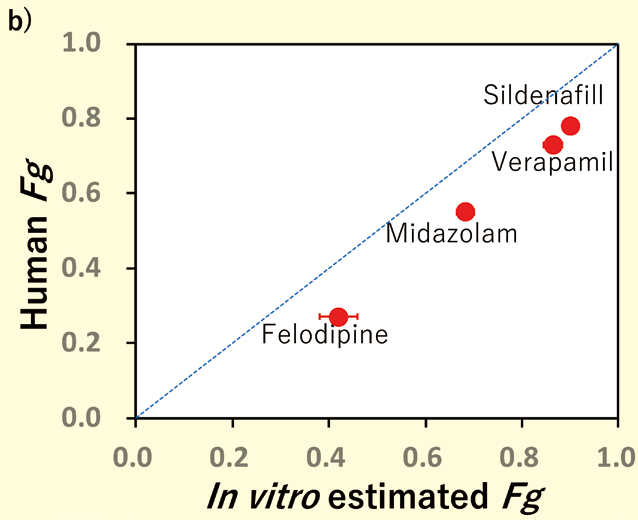
図2. a)代謝物測定を必要とするFg 算出式(式1)とその概念図
b)薬物のFg 値のin vitro(式1より計算)-In vivo(文献値)相関
しかしながら、本予測のためには生成した代謝物を定量する必要がある。通常、創薬の早期段階から代謝物の定量ができることは稀である。前述のヒトcrypt由来分化吸収上皮細胞では、代謝物の定量を必要としない、CYP阻害剤存在下/非存在下における親化合物のPappからFg を予測する方法が提唱されているため、本製品にもこの方法が適用できるかを検討した。図1の培養法 a)では阻害剤存在下でCYP3A4の基質であるMidazolamのPappが阻害剤非存在下と比較して、有意な差が見られなかった。更なるCYP3A4活性向上のため、CYP3A4誘導作用のある活性型ビタミンD3(活性型VD3)を培地に添加して3日間追加培養(図3a)することで、阻害剤存在下/非存在下におけるMidazolamのPappに有意な差が認められ(図3b)、式1および2の両方において算出されたin vitro Fg の予測値はヒトの値0.55と近い値であった(図3c)。

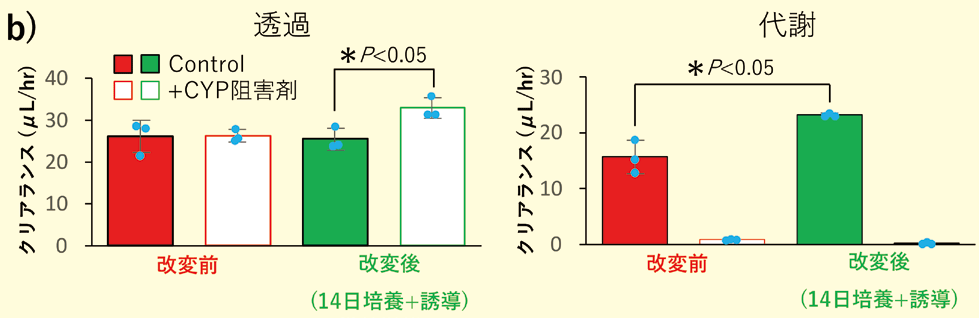
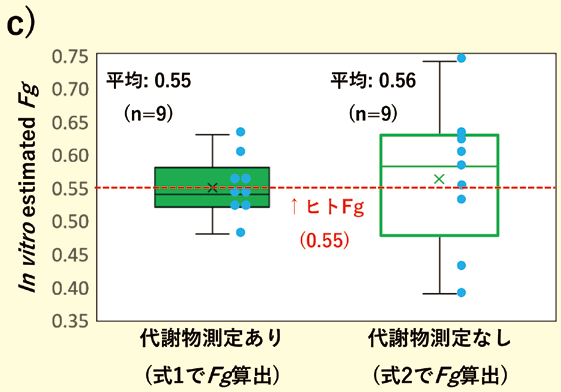
図3.
a)活性型VD3 を含むCulture Medium AL による3日間の追加培養
b)CYP 存在下 / 非存在下におけるMidazolam の透過/ 代謝クリアランス
c)in vitro 実験より推定されるFg 値の比較(式1 vs 式2)
Midazolam以外の化合物に対しても同様の解析を実施し、ヒトFg 値と比較をしたところ良好な相関が確認できた(図4)。以上より、代謝物定量をせずにin vitro からFg を予測できる可能性が示唆された。したがって、より多くの創薬の場面における本製品の活用が期待される。
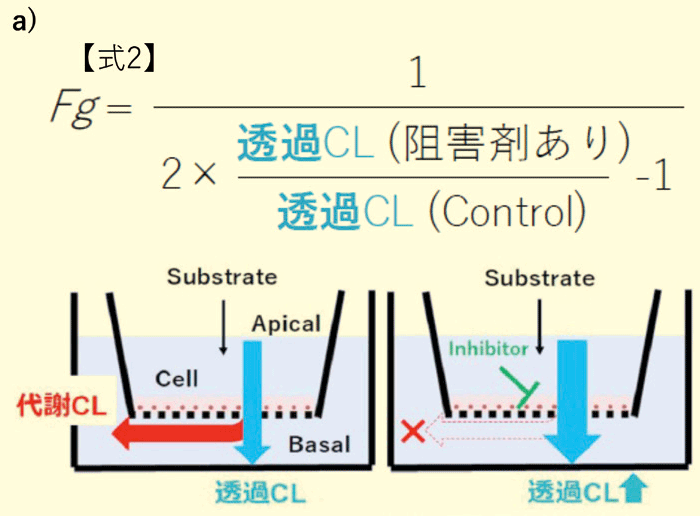
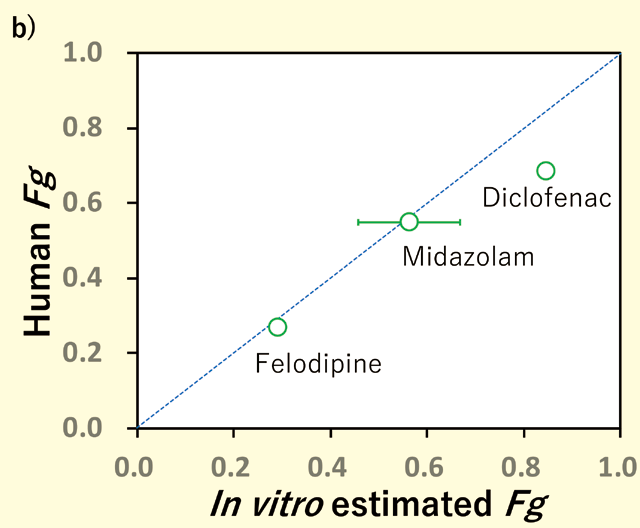
図4. a)代謝物測定を必要としないFg 算出式(式2)とその概念図
b)薬物のFg 値のIn vitro(式2 より計算)-In vivo(文献値)相関
今後の展望
近年、動物実験代替法として、ヒトの体内動態や安全性予測におけるin vitro 評価系も改良が進んでいる。生体模倣システム(MPS)は、より複雑な生体反応を評価するツールとして、国内外で検討されている。本製品もMPSデバイスでの活用事例が報告されており7)、セルカルチャーインサートへの播種時と同様に代謝酵素およびトランスポーターがデバイス上でも機能することが示されている。よって、MPSによる高次な薬物動態評価にも適用できる可能性がある。
今後、より多くの皆様にF-hiSIEC™および本製品をお使いいただき、薬物動態のみならず、創薬およびヒト腸管に関する研究が進展していくことを期待したい。
参考文献
- Kabeya, T. et al. : Drug Metab. Pharmacokinet., 35, 374 (2020).
- Imakura, Y. et al. : Biochem Biophys. Res. Commum., 692, 1949356 (2024).
- Shirai, K. et al. : Drug Metab. Pharmacokinet., 66, 100994 (2024).
- Grass et al. : Adv Drug Deliv. Rev., 54, 433 (2002).
- Iwatsubo, T. et al. : Pharmacol Ther., 73, 147 (1997).
- Michiba, K. et al. : Drug Metab. Dispos., 50, 204 (2022).
- Imaoka, T. et al. : Sci Rep., 14, 29921 (2024).




